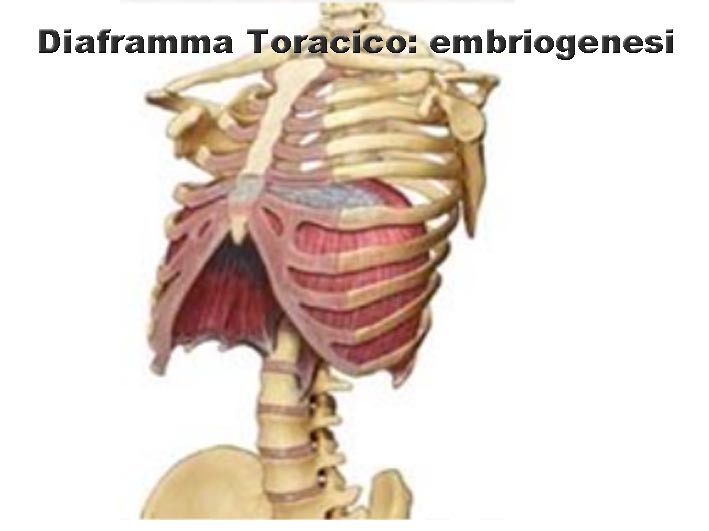
Diaframma Toracico: embriologia
 SVILUPPO EMBRIOGENETICO DEL DIAFRAMMA
SVILUPPO EMBRIOGENETICO DEL DIAFRAMMA
a cura: Saverio Colonna MD (dir. Spine Center, Scuola di Osteopatia OSCE - Bologna)
Il muscolo diaframma dei mammiferi è essenziale per la respirazione, ed è quindi uno dei muscoli scheletrici più importanti nel corpo umano. Difetti di sviluppo di questo muscolo, eventualità abbastanza comune, portano ad ernie diaframmatiche congenite, le quali comportano delle gravi morbilità che possono condurre fino alla mortalità. Data l’importanza funzionale e la frequenza di queste anomalie congenite, risulta importante la comprensione dello sviluppo diaframmatico, sia normale che patologico.
Fonti embrionali del diaframma
Il diaframma si sviluppa da più fonti embrionali. Il muscolo, l’associato tessuto connettivo e il tendine centrale si sviluppano da tre fonti: dal setto trasverso, dalle pieghe pleuroperitoneali e dai somiti.
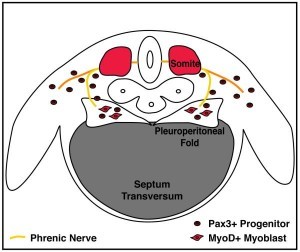 Fig. 1 – fonti embrionali del diaframma. Sviluppo del diaframma di topo a E12.5. Il diaframma si sviluppa dal setto transverso, pieghe pleuroperitoneali e dai somiti, ed è innervato dal nervo frenico
Fig. 1 – fonti embrionali del diaframma. Sviluppo del diaframma di topo a E12.5. Il diaframma si sviluppa dal setto transverso, pieghe pleuroperitoneali e dai somiti, ed è innervato dal nervo frenicoIl setto trasverso è la prima struttura presente nello sviluppo del diaframma e serve come barriera iniziale tra la cavità toracica e addominale (fig. 1). In tutti i vertebrati, il setto trasverso è un sottile foglio di tessuto mesodermico che separa il cuore dal fegato [Perry et al. 2010]. In molti rettili, in tutti gli uccelli e mammiferi, il setto separa il cuore e il polmone dal fegato e resto del contenuto addominale [Perry et al. 2010]. La formazione del Cited2 (originariamente chiamato Mrg1), che si esprime nel topo con il setto trasverso, suggerisce che il setto nasce come mesoderma più rostrale nell’embrione [Dunwoodie et al 1997].
Durante il processo d’invaginazione dello stomaco, l’avvolgimento fa sì che il tessuto Cited2 + il tessuto disteso in posizione caudale al cuore vada a formare il setto trasverso, il quale può essere rilevato nei topi dallo stadio 9-12 somite. E’ stato dimostrato che anche altri geni, come α4-integrina [Pinco et al. 2001] e Pb × 3 [Di Giacomo et al. 2006] possono essere espressione del setto trasverso del giorno embrionale (E) 9 del topo. Non è chiaro che cosa produrrà il setto nell’adulto, anche se alcuni ricercatori hanno suggerito che dia luogo alla componente (non-muscolare) del tendine centrale del diaframma [Iritani 1984]. Tuttavia, senza marcatori o strumenti genetici per seguire il destino del setto, non è ancora chiaro se e ciò che il setto contribuisce a formare nel diaframma adulto. Anche se non esplicitamente testato, durante lo sviluppo il setto è probabile che fornisca l’impalcatura per la morfogenesi del diaframma.
Le pieghe pleuroperitoneali (note anche come piastra mesenchimale retroepatica) sono la seconda componente importante dello sviluppo del diaframma. Le pieghe pleuroperitoneali sono due transitorie strutture a forma piramidale distese su entrambi i lati dell’esofago e che sporgono dalla parete del corpo tra le cavità pleurica e peritoneale (fig. 1). Le pieghe pleuroperitoneali sono state identificate sia istologicamente nelle dissezioni [Iritani 1984, Allan e Greer 1997] che tramite microscopia elettronica a scansione [Kluth et al. 1993, 1 Kluth et al. 1996]. Le cellule che compongono le pieghe pleuroperitoneali, molecolarmente, esprimono il NR2F2 recettore nucleare (noto anche come Coup-TFII) e fattori di trascrizione WT1 e GATA4 [Clugston et al. 2008]. Nel topo, le pieghe pleuroperitoneali sono prima presenti allo stadio E11 [Iritani 1984], proliferano (per essere più evidenti a E12.5), poi sembrano diffondersi ventrale e alla fine si pensa che si fondano con il setto [Iritani 1984, Allan e Greer 1997]. Attualmente non è noto se le pieghe pleuroperitoneali sono strutture embrionali semplicemente transitorie senza derivazioni nell’adulto o se danno origine a cellule o tessuti del diaframma maturo.
I somiti, similmente ai muscoli del tronco e degli arti, sono fonte di cellule muscolari del diaframma [Allan e Greer 1997, Dietrich et al. 1999, Babiuk et al. 2003]. La prova che il muscolo del diaframma proviene dai somiti proviene dall’analisi del fattore di trascrizione Pa × 3 e dal recettore della tirosina chinasi Met (noto anche come c-Met). Entrambi questi geni sono fortemente rappresentati nei progenitori muscolari dei somiti [Buckingham 2007, Yang et al 1996]. Questi geni, inoltre, sono necessari ai progenitori muscolari per emigrare dai somiti e formare i muscoli dell’arto e del tronco. Sorprendentemente, i topi con mutazioni nulle in entrambi Pa × 3 o Met non hanno i muscoli degli arti o il diaframma (sia la parte costale che crurale) [Dietrich et al. 1999, Bladt et al. 1995, Tajbakhsh et al. 1997, Tremblay et al. 1998]. Alcuni studi [Allan e Greer 1997, Dietrich et al. 1999, Babiuk et al. 2003] mostrano che i progenitori muscolari del diaframma provengono dai somiti cervicali, probabilmente C3- C5.
Migrazione di muscoli e nervi nel diaframma in sviluppo
I progenitori muscolari e gli assoni del nervo frenico migrano , rispettivamente, dai somiti e tubo neurale al diaframma in sviluppo. L’obiettivo della loro migrazione è le pieghe pleuroperitoneali [Allan e Greer 1997, Babiuk et al. 2003]. Nei topi, gli assoni del nervo frenico e i progenitori muscolari migrano verso le pieghe da E10.5 [Allan e Greer 1997, Dietrich et al. 1999, Babiuk et al. 2003]. Il nervo frenico emigra dopo i progenitori muscolari ed emigra inizialmente con i nervi del plesso brachiale prima che le pieghe si separino e si differenzino [Allan DW, Greer 1998]. Quando i nervi e progenitori muscolari raggiungono le pieghe, le pieghe sono situate a livello dei somiti cervicali. Tuttavia, gradualmente le pieghe e il diaframma in sviluppo con i suoi nervi e muscoli discendono caudalmente, fino distendersi al confine toraco/lombare [Allan e Greer 1997].
Le pieghe pleuroperitoneali sono verosimilmente una fonte importante di segnali che guidano la migrazione di nervi e muscoli al diaframma in via di sviluppo. La nostra conoscenza della natura molecolare di questi segnali è limitata. Le molecola di adesione delle cellule neurali (Neural cell adhesion molecule) e la bassa affinità del fattore di crescita nervoso (low-affinity nerve growth factor receptor) sono presenti lungo il percorso dal tubo neurale alle pieghe pleuroperitoneali e possono guidare l’escrescenza del nervo frenico [Allan e Greer 1997]. Inoltre, il fattore di crescita degli epatociti (HGF), legante per il recettore Met, è presente lungo il percorso migratorio sia per i progenitori dei muscoli che dei nervi [Dietrich et al 1999]. La constatazione che l’HGF nulla dei topi non presentano il muscolo diaframmatico suggerisce fortemente che HGF è importante per la guida dei progenitori miogenici al diaframma in sviluppo [Maina et al. 1996]. L’HGF può anche essere fondamentale per lo sviluppo del nervo frenico [Ebens et al. 1996, Yamamoto et al. 1997].
Morfogenesi del Diaframma
Per produrre un diaframma funzionale, la morfogenesi del muscolo, tessuto muscolo connettivale e tendini derivati da queste diverse fonti embrionali devono non solo essere coordinata solo tra loro, ma anche con i nervi e vasi.
Dopo aver raggiunto le pieghe pleuroperitoneali, i progenitori muscolari subiscono i processi di miogenesi e morfogenesi. Durante la miogenesi, i progenitori muscolari si differenziano in fibre muscolari multinucleate. Simile ai muscoli del tronco e degli arti, i progenitori del diaframma inizialmente esprimono fattori di trascrizione Pa × 3 e Pa × 7. Questi progenitori diventano mioblasti impegnandosi a produrre i fattori di trascrizione Myf5 e MyoD, si differenziano in miogenina + miociti, e, infine, si fondono per formare fibre muscolari multinucleate [Babiuk et al. 2003, Murphy et al. 2011]. Pa × 3/7 + progenitori muscolari e MyoD + mioblasti sono presenti nelle pieghe pleuroperitoneali dei topi di E12.5 [E13.5 dei ratti]; [Babiuk et al. 2003]. Successivamente i progenitori si differenziano in mioblasti e poi si fondono in miofibre, che vengono assemblati nei muscoli costali e crurali. La morfogenesi del diaframma costale è stata descritta più dettagliatamente [Babiuk et al. 2003]. Le miofibre prima cominciano differenziarsi nelle regioni postero laterali sinistra e destra di ciascun emidiaframma. Tra E12.5 e E15.5 un’ondata di differenziazione si espande sia ventralmente, dorsalmente che medialmente (verso il tendine centrale) e lateralmente (verso le costole) di ogni emi diaframma. La morfogenesi del diaframma costale è in gran parte completata da E15.5. Non è ancora chiaro cosa guida questo processo morfogenetico, cosa orienta le miofibre per formare una matrice radiale, e perché la regione tendine centrale è privata del muscolo.
La morfogenesi del tessuto muscolo connettivale del diaframma, del tendine centrale e il loro rapporto con il setto trasverso e le pieghe pleuroperitoneali rimane poco compresa. Sulla base di analisi istologica attraverso dissezioni di embrioni in sviluppo di topo, è stato proposto che il setto trasverso, inizialmente presente sulla superficie craniale del fegato, rimane in posizione e dà luogo alla tendine centrale [Iritani et al. 1984]. Le pieghe pleuroperitoneali hanno una morfogenesi complicata. Dopo E12.5 le pieghe, inizialmente situate adiacenti ai somiti cervicali, scendono caudale (insieme con i nervi frenici e progenitori muscolari) per raggiungere il confine toracico/lombare [Allan e Greer 1997]. E’ stato valutato, utilizzando microscopio elettronico a scansione di una serie di embrioni in via di sviluppo, che le pieghe pleuroperitoneali in seguito sembrano diffondersi per coprire la superficie craniale del fegato e si fondono con la setto transverso [Kluth et al. 1993, 1996]. La natura molecolare e cellulare delle interazioni tra le pieghe e il setto non è nota. Inoltre, non è chiaro qual’è il destino ultimo delle pieghe; le pieghe possono essere semplicemente strutture embrionali transitorie o possono produrre le parti non muscolari del diaframma. Attualmente, è sconosciuto se il muscolo del tessuto connettivo e tendine centrale derivino dal setto, dalle pieghe pleuroperitoneali o qualche altra fonte embrionale.
La vicinanza delle cellule muscolari e non muscolari, che presumibilmente danno origine al tessuto connettivo muscolare e tendine centrale, suggeriscono che le interazioni cellula-cellula tra questi tessuti possono essere critiche per il corretto sviluppo del diaframma. È interessante notare che l’analisi di Met null dei topi, in cui progenitori muscolari non migrano nel diaframma in sviluppo, dimostrano che il tessuto connettivo è presente anche in assenza del muscolo [Babiuk et al. 2002]. Così il tessuto connettivo si sviluppa, almeno inizialmente, indipendentemente dal muscolare, anche se non è chiaro se i tessuti distinti come il tendine centrale si formino. Se il diaframma muscolare richieda segnali dal tessuto connettivo muscolare e/o tendine centrale in via di sviluppo non è ancora stato appurato.
L’innervazione del diaframma è critica per lo sviluppo di un diaframma completamente funzionante. Dopo aver raggiunto le pieghe pleuroperitoneali, le branche dei nervi frenici devono diffondersi e innervare il diaframma in via di sviluppo attraverso la formazione delle giunzioni neuromuscolari con le miofibre differenziate. Dopo aver raggiunto le pieghe pleuroperitoneali, dal E13.5 il nervo frenico si divide in tre rami: sternocostale, dorsocostale, e ramo crurale [Uetani et al. 2006]. Il ramo sternale si estende e attraversano la linea mediana del diaframma prima di raggiungere le sua posizione finale [Babiuk et al. 2003]. I tre rami principali, successivamente, inviano brevi rami secondari, si ramificano formando le giunzioni neuromuscolari con la componente muscolare costale e crurale. Attualmente si cominciano a conoscere i segnali molecolari e le interazioni cellulari che controllano l’estensione assonale, le ramificazione e la formazione delle giunzioni neuromuscolari. Per la ramificazione del nervo frenico sono necessari i recettori della proteina tirosina fosfatasi σ e δ, infatti i nervi frenici raggiungono le pieghe pleuroperitoneali ma non riescono a estendersi e ramificarsi adeguatamente nei topi mutanti per questa fosfatasi [Uetani et al. 2006]. Inoltre, Hoxa5 e Hoxc5 sono necessari per la corretta ramificazione secondaria del nervo frenico, come la cancellazione di questi geni nei moto neuroni evolva in una grave riduzione di ramificazione e limitata formazione di sinapsi con il muscolo [Philippidou et al. 2012 ]. Sono critiche anche le interazioni tra muscoli e nervi per le ramificazioni secondaria e la formazione delle giunzioni neuromuscolari [Lewis et al 1981]. Esperimenti di mutagenesi condizionata nei topi hanno rilevato che la ramificazione secondaria e arborizzazione del nervo frenico sono regolate tramite catenina β all’interno del muscolo, dimostrando che i segnali di derivazione muscolare regolano lo sviluppo del nervo frenico [Li et al. 2008, Wu et al. 2012]. Inoltre, un gran numero di studi hanno dimostrato che la formazione delle giunzioni neuromuscolari del nervo frenico comporta una complessa interazione di segnalazione muscolo-nervo retrograda e anterograda [Burden 2011, Wu et al. 2010].
Infine, anche la vascolarizzazione del diaframma è essenziale per lo sviluppo diaframma. Questa è un’area di ricerca limitata. Tuttavia, un recente studio, utilizzando topi transgenici XLacZ4, che etichettano i nuclei delle cellule muscolari lisce vascolari, mostra la vascolarizzazione del diaframma dalle arterie freniche, intercostali e toraciche interne. L’uso dei topi transgenici XLacZ4 permette la visualizzazione delle strutture di ramificazione complesse di entrambe le arterie e vene. Questo lavoro fornisce la prima descrizione dettagliata della vascolarizzazione del diaframma ed è una utile partenza per la ricerca futura [Stuelsatz et al. 2012].
BIBLIOGRAFIA
Allan DW, Greer JJ. Embryogenesis of the phrenic nerve and diaphragm in the fetal rat. J Comp Neurol. 1997; 382:459–68.
Allan DW, Greer JJ. Polysialylated NCAM expression during motor axon outgrowth and myogenesis in the fetal rat. J Comp Neurol. 1998; 391:275–92.
Babiuk RP, Greer JJ. Diaphragm defects occur in a CDH hernia model independently of myogenesis and lung formation. Am J Physiol Lung Cell Mol Physiol. 2002; 283:L1310–4.
Babiuk RP, Zhang W, Clugston R, Allan DW, Greer JJ. Embryological origins and development of the rat diaphragm. J Comp Neurol. 2003; 455:477–87.
Bladt F, Riethmacher D, Isenmann S, Aguzzi A, Birchmeier C. Essential role for the c-met receptor in the migration of myogenic precursor cells into the limb bud. Nature. 1995; 376:768– 71.
Buckingham M. Skeletal muscle progenitor cells and the role of Pax genes. C R Biol. 2007; 330:530–3.
Burden SJ. SnapShot: Neuromuscular Junction. Cell. 2011; 144:826–826.
Clugston RD, Zhang W, Greer JJ. Gene expression in the developing diaphragm: significance for congenital diaphragmatic hernia. Am J Physiol Lung Cell Mol Physiol. 2008; 294:L665–75.
Di Giacomo G, Koss M, Capellini TD, Brendolan A, Popperl H, Selleri L. Spatio-temporal expression of Pbx3 during mouse organogenesis. Gene Expr Patterns. 2006; 6:747–57.
Dietrich S, Abou-Rebyeh F, Brohmann H, Bladt F, Sonnenberg-Riethmacher E, Yamaai T, Lumsden A, Brand-Saberi B, Birchmeier C. The role of SF/HGF and c-Met in the development of skeletal muscle. Development. 1999; 126:1621–9.
Dunwoodie SL, Rodriguez TA, Beddington RS. Msg1 and Mrg1, founding members of a gene family, show distinct patterns of gene expression during mouse embryogenesis. Mech Dev. 1998; 72:27–40.
Iritani I. Experimental study on embryogenesis of congenital diaphragmatic hernia. Anat Embryol (Berl). 1984; 169:133–9.
Kluth D, Keijzer R, Hertl M, Tibboel D. Embryology of congenital diaphragmatic hernia. Semin Pediatr Surg. 1996; 5:224–33.
Kluth D, Tenbrinck R, von Ekesparre M, Kangah R, Reich P, Brandsma A, Tibboel D, Lambrecht W. The natural history of congenital diaphragmatic hernia and pulmonary hypoplasia in the embryo. J Pediatr Surg. 1993; 28:456–62.
Lewis J, Chevallier A, Kieny M, Wolpert L. Muscle nerve branches do not develop in chick wings devoid of muscle. J Embryol Exp Morphol. 1981; 64:211–32.
Li XM, Dong XP, Luo SW, Zhang B, Lee DH, Ting AK, Neiswender H, Kim CH, Carpenter- Hyland E, Gao TM, Xiong WC, Mei L. Retrograde regulation of motoneuron differentiation by muscle beta-catenin. Nature neuroscience. 2008; 11:262–8.
Maina F, Casagranda F, Audero E, Simeone A, Comoglio PM, Klein R, Ponzetto C. Uncoupling of Grb2 from the Met receptor in vivo reveals complex roles in muscle development. Cell. 1996; 87:531–42.
Murphy M, Kardon G. Origin of vertebrate limb muscle: the role of progenitor and myoblast populations. Curr Top Dev Biol. 2011; 96:1–32.
Perry SF, Similowski T, Klein W, Codd JR. The evolutionary origin of the mammalian diaphragm. Respir Physiol Neurobiol. 2010; 171:1–16.
Philippidou P, Walsh CM, Aubin J, Jeannotte L, Dasen JS. Sustained Hox5 gene activity is required for respiratory motor neuron development. Nature neuroscience. 2012; 15:1636–44.
Pinco KA, Liu S, Yang JT. Alpha4 integrin is expressed in a subset of cranial neural crest cells and in epicardial progenitor cells during early mouse development. Mech Dev. 2001; 100:99–103.
Stuelsatz P, Keire P, Almuly R, Yablonka-Reuveni Z. A contemporary atlas of the mouse diaphragm: myogenicity, vascularity, and the Pax3 connection. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 2012; 60:638–57.
Tajbakhsh S, Rocancourt D, Cossu G, Buckingham M. Redefining the genetic hierarchies controlling skeletal myogenesis: Pax-3 and Myf-5 act upstream of MyoD. Cell. 1997; 89:127–38.
Tremblay P, Dietrich S, Mericskay M, Schubert FR, Li Z, Paulin D. A crucial role for Pax3 in the development of the hypaxial musculature and the long-range migration of muscle precursors. Dev Biol. 1998; 203:49–61.
Uetani N, Chagnon MJ, Kennedy TE, Iwakura Y, Tremblay ML. Mammalian motoneuron axon targeting requires receptor protein tyrosine phosphatases sigma and delta. J Neurosci. 2006; 26:5872–80.
Wu H, Lu Y, Barik A, Joseph A, Taketo MM, Xiong WC, Mei L. beta-Catenin gain of function in muscles impairs neuromuscular junction formation. Development. 2012; 139:2392–404.
Wu H, Xiong WC, Mei L. To build a synapse: signaling pathways in neuromuscular junction assembly. Development. 2010; 137:1017–33. 42.
Yamamoto Y, Livet J, Pollock RA, Garces A, Arce V, deLapeyriere O, Henderson CE. Hepatocyte growth factor (HGF/SF) is a muscle-derived survival factor for a subpopulation of embryonic motoneurons. Development. 1997; 124:2903–13.
Yang XM, Vogan K, Gros P, Park M. Expression of the met receptor tyrosine kinase in muscle progenitor cells in somites and limbs is absent in Splotch mice. Development. 1996; 122:2163–71.
Estratto dal lavoro:
Development of the diaphragm – a skeletal muscle essential for mammalian respiration.
Allyson J. Merrell and Gabrielle Kardon
FEBS Journal (2013) 280: 4026–4035